01導讀
氨作為各種含氮肥料的前驅體和主要組成部分,在滋養全球人口方面發揮著重要作用,同時,氨生產占全球能源消耗和碳排放量的1%左右。在大型集中設施中,通過高溫高壓Haber-Bosch (HB)工藝合成氨。為了實現可持續的氨合成工藝,該工藝盡可能在低得多的溫度下運行,從而緩解當前HB工藝中對高壓的需求。因此,需要發展全新的催化劑,降低制造氨的資本需求和能源消耗。
02成果背景
在此,丹麥技術大學Jens K. N?rskov團隊提出了一類新的釕基催化劑,采用原位制備技術,釕/碳催化劑在高壓推流式反應器中由金屬銫蒸汽直接促進,同時保持O2和H2O的內部分壓非常接近零。開發的原位促進催化劑的速率比350℃以下的常規原位促進催化劑的速率高出1個數量級以上。高活性歸因于活化能大大降低,使催化劑更適合在低溫下進行氨合成。相關工作以“Enhanced promotion of Ru-based ammonia catalysts by in situ dosing of Cs”為題發表在Energy & Environmental Science上。
03關鍵創新 該工作提出了一種原位制備技術,用金屬銫促進的新型釕基催化劑。采用這種新技術制備的催化劑的活性高出約10倍。原位促進的催化劑具有較小的表觀活化能,并且對H2中毒不敏感。
04核心內容解讀
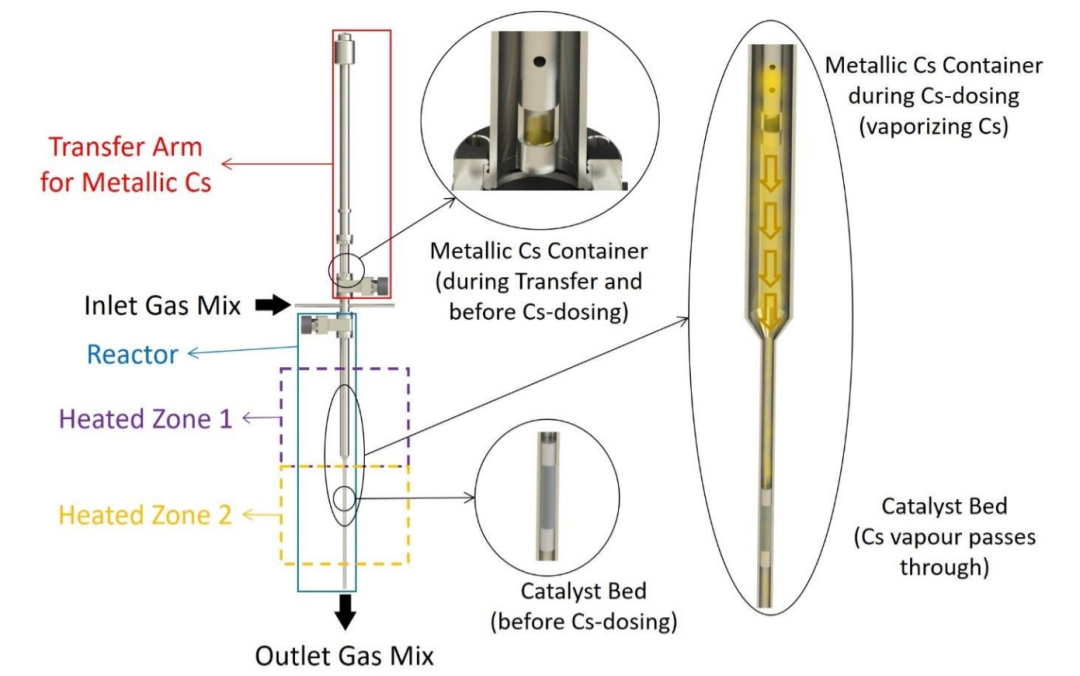
圖1 原位金屬蒸汽劑量器和固定床反應器示意圖。@RSC
在本工作中,Ru/C樣品直接用金屬Cs蒸氣促進,并在不暴露于空氣的情況下進行測試。為此,設計了用于將金屬Cs原位投加到催化劑中反應器裝置的附加裝置(圖1)。該系統由一個超高真空兼容的轉移臂組成,該轉移臂配備一個用于裝金屬Cs的小杯。轉移臂在Ar手套箱中裝金屬Cs,然后將臂連接到裝置上,允許裝有Cs的杯在催化劑床附近的反應器內移動。然后,將系統抽真空并用Ar吹掃數次,確保系統中沒有氧氣。為了使Cs蒸發,裝金屬Cs杯的溫度獨立于催化劑床溫度進行控制。在10 bar的Ar流中將Cs加入催化劑,裝Cs的杯保持在 450 ?C,催化劑床在400 ?C。幾小時后,將流量切換到N2+H2混合物進行不同條件下的反應測量。
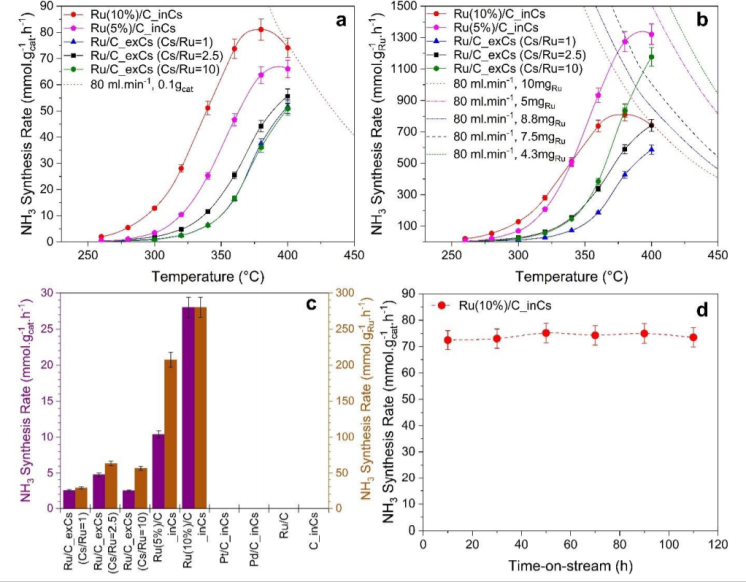
圖2通過非原位或原位促進技術用Cs促進的不同Ru/C催化劑上的氨合成速率:(a)基于負載催化劑的總重量歸一化,(b)基于負載的Ru總重量歸一化。a和b中的虛線/點線表示氨合成的平衡速率;(c)不同催化劑在320 ?C下氨合成速率的比較;(d)原位促進催化劑在400 ?C的運行時間活性測量。(反應條件:0.1 g催化劑,10 bar,總流量80 ml.min-1,H2/N2=3,WHSV=48,000 ml.g-1.h-1)@RSC
為了研究無氧促進(Ru/C_inCs)的催化效果,并將其與傳統的空氣中非原位促進(Ru/C_exCs)進行了一系列催化劑活性測量。圖2a和圖2b中的點劃線表示氨合成的平衡速率。在遠離平衡(<360 ?C)的溫度下,動力學占主導地位,與非原位促進的催化劑相比,原位促進的催化劑的活性比非原位高約10倍。圖2a-c的結果表明,原位促進催化劑的較高氨合成速率不能簡單地歸因于較高的Cs/Ru比。如圖2d所示測試了原位促進催化劑的穩定性。當實驗停止時,催化劑可以具有長達110小時的穩定性能。原位促進催化劑性能穩定的一個重要原因是不含含氧化合物的超潔凈系統。
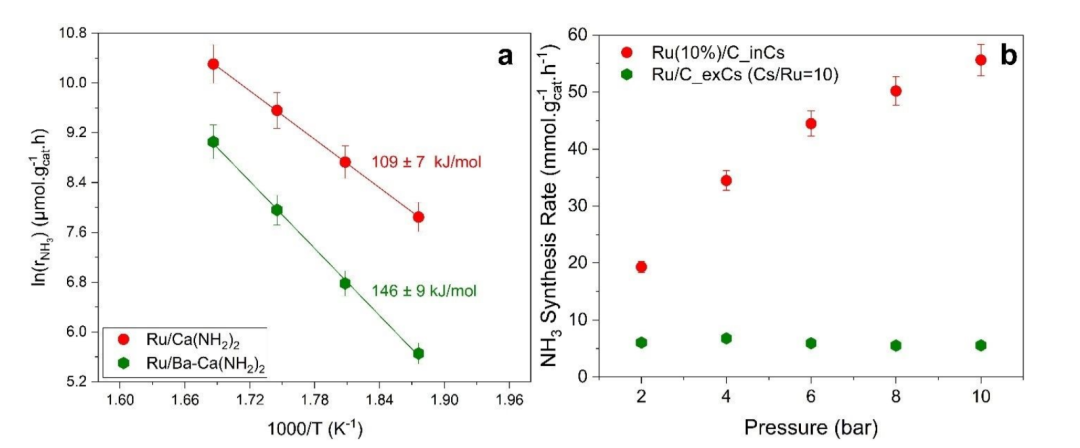
圖3 (a)Ru/C_inCs和Ru/C_exCs在10 bar時的Arrhenius圖和活化能;(b)使用0.1 g催化劑在340 ?C、2至10 bar、總流量為80 ml.min-1、H2/N2= 3和WHSV=48,000 ml.g-1.h-1時氨合成速率與總壓力的關系。@RSC
圖3a是通過原位和非原位技術,用Cs促進的Ru/C催化劑的Arrhenius圖和計算的表觀活化能。這些催化劑的活化能之間存在顯著差異。兩種催化劑都觀察到輕微的NH3抑制效果。盡管,原位和非原位Cs促進催化劑的NH3和N2級數大致相同,但H2反應級數顯著不同(圖3b)。與非原位促進的催化劑相比,原位促進的催化劑的H2抑制作用要小得多。當壓力從2 bar 增加到10 bar時,原位促進催化劑的活性增加約3倍,而非原位促進催化劑的性能不會隨著反應壓力的增加而減弱的H2抑制作用。
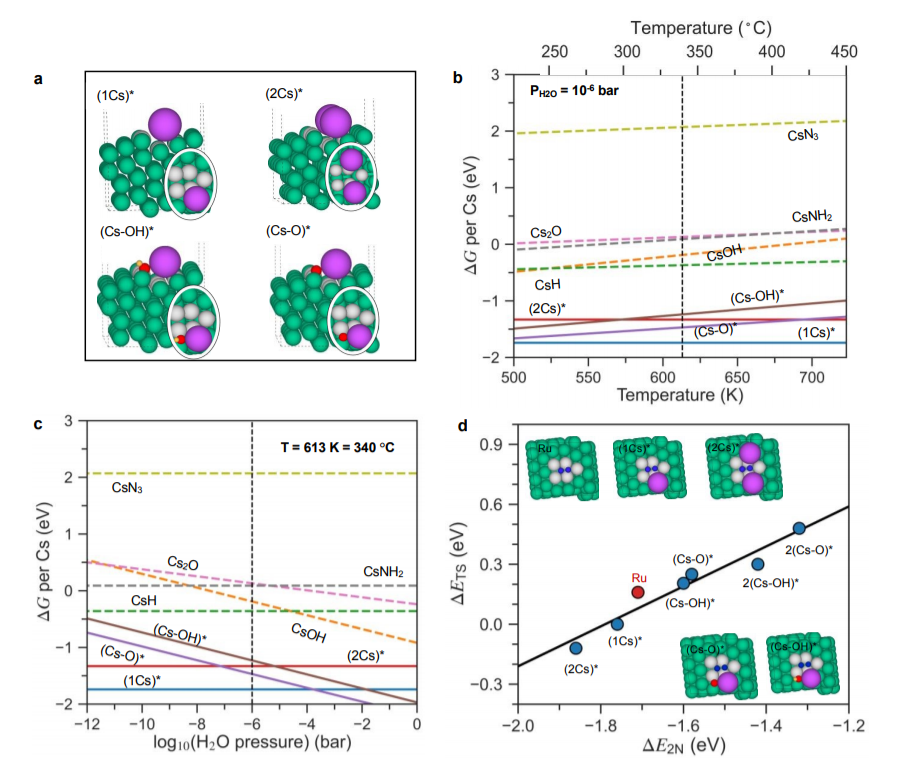
圖4 (a)共吸附1Cs*、2Cs*、(Cs-O)*和(Cs-OH)*物種在Ru表面步驟的側視圖和俯視圖(橢圓形);(b-c)在反應條件下促進Ru與其氧化物、氫氧化物、氫化物、酰胺和氮化物平衡,作為溫度和H2O壓力的函數。b的反應條件為PH2= 7.125 bar,PNH3=0.25 bar(N2轉化率為5%),PH2O=10-6bar,選擇用于模擬極其干燥的反應氣體;c的反應條件是T=340 °C,PH2=7.125 bar,PNH3=0.25 bar(N2轉化率為5%;基于N2轉化率2%和10%的相圖也計算并呈現在圖S9中)。游離物種顯示為虛線,而吸附的物種顯示為實線并由*標識。所有能量都是每個Cs原子相對于體相Cs;(d)N2解離勢壘(ΔETS)與N2解離能(ΔE2N)之間的比例關系。綠色、紫色、紅色、黃色和藍色球體分別代表Ru、Cs、O、H和N原子。活性位點的Ru原子用灰色標記。@RSC
圖4a為計算的表面相圖來探索活性相。該圖比較了不同前體化合物(即本體Cs2O、CsOH、CsN3和CsH)中的Cs在典型氨合成條件下的自由能。如圖4b和c所示,高度促進的原位樣品比非原位、低Cs覆蓋率的系統更容易發生氧中毒。圖4d證明,Cs*是N2解離的良好促進劑,對于高Cs覆蓋更是如此。高Cs覆蓋率催化劑促進較好的原因如下:吸附Cs的促進作用與表面外Cs誘導電場與過渡態N2分子誘導的偶極子之間的吸引力相互作用有關。在高Cs覆蓋率表面下,過渡態分子接近兩個Cs原子(圖4d),這意味著吸附平面是約兩倍大,因此過渡態的穩定性更大。
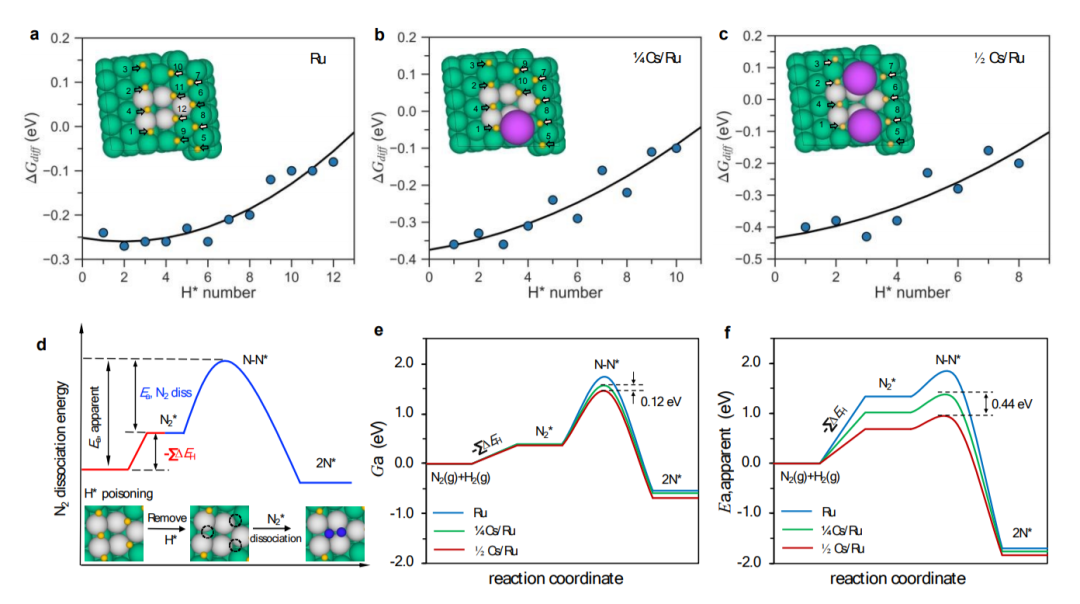
圖5 (a-c)在Ru、1/4Cs/Ru和1/2Cs/Ru表面吸附H的覆蓋率依賴的微分結合能與吸附H原子數的關系。灰色陰影區域表示在T=340 °C和PH2=7.125 bar時的放能吸附;(d)H*毒化釕表面上的N2解離。綠色、藍色和黃色球體分別代表Ru、N和H。活性位點上的Ru原子用灰色標記;(e-f)Ru、1/4Cs/Ru和1/2 Cs/Ru表面上N2解離的自由能壘和表觀勢壘—低覆蓋率情況模擬非原位促進,高覆蓋率情況模擬原位促進。@RSC
如圖5a-c所示,在實驗條件下,N2解離位點周圍所有H原子的自由能均低于0 eV,這意味著活性臺階位點都被非促進Ru上的氫完全覆蓋,以及在?和?Cs覆蓋范圍內。這意味著需要在N2解離之前需要除去共吸附H*物種。如圖5d所示,活性位點周圍的三個H*原子需要在原始Ru表面上的N2解離之前去除。在低Cs覆蓋率的模型中,一個Cs原子取代了較低臺階上的一個阻塞H*吸附位點(圖5b),因此另外兩個H原子位點必須被去除。對于高Cs覆蓋模型,H2的級數應為-0.5,在解離之前,只有一個具有負吸附自由能的H原子需要去除。觀察到測得的活化能發生較大變化,而速率變化相對較小,這就是所謂的補償效應。
05成果啟示
本文深入研究了Cs的促進作用,并表明純金屬Cs的原位投加對于氨合成來說,比常規制備的用Cs促進的非原位Ru催化劑的活性好得多。盡管高活性原位促進催化劑無法達到理想的溫和條件標準(即<200?C),但這項工作的主要優點之一是提供了對促進效應的深入探究,為發現高活性催化劑開辟了道路。該方法可以用于制備在溫和條件下合成氨的活性催化劑,用于可持續的HB工藝。此外,原位促進催化劑表明,通過原位促進技術提高已知高活性氨催化劑的性能具有巨大潛力。這項技術及其潛力可以幫助氨催化劑研究領域擺脫使用稀有元素和復雜的前體化合物來合成新的催化劑。
06參考文獻 Vahid Shadravan, ANG CAO, Vanessa Jane Bukas, Mette K. Gr?nborg, Christian Danvand Damsgaard, Zhenbin Wang, Jakob Kibsgaard, Jens Kehlet Norskov and Ib Chorkendorff. Enhanced promotion of Ru-based ammonia catalysts by in situ dosing of Cs, Energy & Environmental Science, 2022. https://doi.org/10.1039/D2EE00591C
審核編輯 :李倩
-
催化劑
+關注
關注
0文章
93瀏覽量
10326 -
反應器
+關注
關注
2文章
100瀏覽量
11127 -
制備技術
+關注
關注
0文章
9瀏覽量
10094
原文標題:EES:原位加入銫,促進釕基催化劑合成氨
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
一文解讀氧化石墨烯制備的研究進展

異質結類型的介紹




理濤-催化劑磨損指數測定儀 催化劑磨耗測試儀-視頻解說 #催化劑磨損指數測定儀 #催化劑磨耗測試儀 #理濤
實時原位監測光電催化過程中反應物濃度與熱效應的微光纖傳感器技術
蔡司X射線顯微CT和SEM電鏡檢測燃料電池材料

蔡司X射線顯微鏡和掃描電鏡檢測燃料電池材料

請問INA38一類的電流檢測芯片被測電流與芯片可以不共地嗎?
網關助力催化劑產業升級,解決痛點問題!





 一類新的釕基催化劑,采用原位制備技術
一類新的釕基催化劑,采用原位制備技術










評論