組織工程具有開發體外器官模型系統的巨大潛力。隨著2000年代后期開始的小型化趨勢,三維(3D)微組織模型已被用于研究受損纖維組織的修復、心肌和肺組織的形成和成熟等組織生物學的基本特征。此外,由于具有較高的空間和時間分辨率,光遺傳學已成為時空控制細胞信號轉導的強大工具。
目前,通過對RhoA活性進行光遺傳學控制,已有一些研究可以使用光脈沖來局部上調或下調細胞產生的力。Valon等人的進一步研究證明,細胞張力的變化與二維上皮單層中的組織變形有關,表明細胞具有作為機械執行器的潛力。這種生物執行器可用于使用光誘導的生理機械刺激來探測組織力學。
據麥姆斯咨詢報道,近期,法國格勒諾布爾-阿爾卑斯大學(University Grenoble Alpes)的研究人員結合組織工程和光遺傳學技術,設計了由封裝在膠原蛋白中的光基因修飾的成纖維細胞組成的微組織,并通過利用光來控制調節細胞收縮性的主要因子——RhoA的活性,成功在微組織內誘導了局部收縮,并實現了對微組織應力和應變的監測。相關研究成果以“Light-driven biological actuators to probe the rheology of 3D microtissues”為題,發表于Nature Communications期刊。
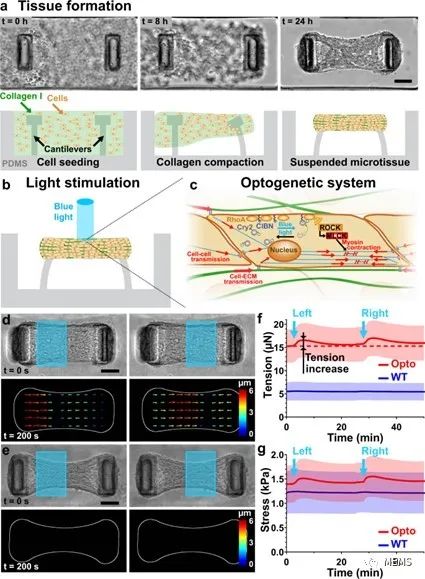
圖1 微組織的光控收縮
基于所提出的組織工程耦合光遺傳學的方法,該研究實現了對微組織特定部分應力的時空控制和測量,并通過粒子圖像測速儀(PIV)進一步實現了對組織應變的推斷。此外,研究人員對微組織的流變性進行了探索,并證明了所提出的方法在量化懸臂剛度、細胞外基質(ECM)以及成纖維細胞向肌成纖維細胞的分化對組織彈性的影響方面的潛力。最后,該研究展示了所提出的方法在機械異質性微組織中測定局部各向異性,以及在組織形成過程中使用重復刺激影響組織結構的能力。
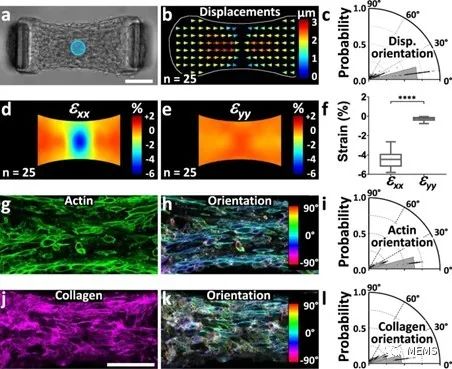
圖2 光遺傳學誘導收縮的各向異性與微組織結構相關
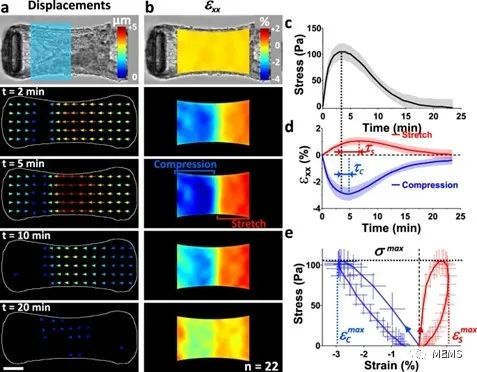
圖3 光誘導的局部收縮證明了微組織的粘彈性
總之,組織工程和光遺傳學的結合提供了獨特的方法來定量證明物理和生物參數對3D組織中細胞引起的機械擾動的產生、傳播和傳感的影響。最重要的是,該方法為使用構成3D組織的細胞本身作為內部執行器實時和非破壞性地探測3D組織的流變性鋪平了道路。總而言之,將細胞收縮性的光遺傳學控制與專門設計的具有特定幾何形狀的微組織以及相應的計算模型結合,可以提供一種強大的方法來分析機械邊界約束、細胞收縮性、細胞外基質密度、排列和機械特性之間復雜的相互作用。
然而,由于該方法通過利用組織中的一部分(受刺激的部分)的收縮來拉伸另一部分(未受刺激的部分)的方式來探測后者的機械特性,因此它本質上需要肌動球蛋白的活躍運轉,這可能使對于細胞骨架成分在調節組織力學中的作用的研究復雜化。事實上,完全抑制微組織的收縮能力,例如使用高劑量的肌動球蛋白靶向藥物,會阻礙該方法的使用。然而,只要收縮機制至少部分活躍,該方法就仍然有效,例如,只使用中小劑量的肌動球蛋白靶向藥物。
此外,盡管CRY2富集到細胞膜的速度非常快(幾秒鐘),但它的解離速度較慢(幾分鐘),而RhoA通路的激活導致細胞先發生時長數十秒的收縮性激活,而后歷經更為緩慢的時長幾分鐘的松弛。因此,細胞誘導性收縮和松弛需要將近20分鐘,因此無法將其用于探測快速機械變化或量化微組織在不同頻率下的時間依賴性機械響應。最后,該方法中的光遺傳學靶標RhoA有許多下游效應器。雖然該研究使用單一的、短時間的刺激來誘導微組織的彈性反應,而不產生類似細胞骨架重塑等類型的持久影響,仍然不能排除可能存在通過例如RhoA的自我放大和自我抑制產生的脫靶效應。
審核編輯:劉清
-
效應器件
+關注
關注
0文章
2瀏覽量
5569 -
ECM
+關注
關注
3文章
56瀏覽量
28050 -
SPIV
+關注
關注
0文章
2瀏覽量
1666 -
測速儀
+關注
關注
0文章
22瀏覽量
4076
原文標題:光驅動生物執行器,可用于探測3D微組織流變性
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
高分子微納米功能復合材料3D打印加工介紹

光學系統的3D可視化
速程精密直線旋轉執行器:工業自動化的核心驅動力
安泰功率放大器在微納光固化3D打印中的具體應用

音圈執行器:精密構造的科技杰作
電動執行器的標準輸入信號范圍是多少v
電動執行器常見故障及處理方法
氣動執行器換電動執行器怎么換

多尺度浸入式3D打印策略,用于人體組織和器官的精準制造
機電執行器需要智能集成驅動器解決方案以增強邊緣智能





 用于探測3D微組織流變性的光驅動生物執行器
用于探測3D微組織流變性的光驅動生物執行器













評論