軍用熱電池又叫熱激活電池是一次性電池,用于作為炮彈的引爆電源或者導彈、核武器的工作電源,工作時間幾秒~60min,炮彈引爆完,電池也灰飛煙滅。燃料電池不是一次性電池,加了氫就像汽車,加了汽油就能源源不斷提供電力。
發展歷程
第二次世界大戰末期,德國Erb博士首先發明了熱電池,戰后熱電池技術傳到美國,引起美國國家標準局和武器發展部的重視。1948年烏利切(Wurlitzer)公司開始生產第一個熱電池并實際應用在迫擊炮彈中;1955年美國SAND實驗室研制成功使用壽命為5min左右的熱電池,并應用在核武器上。
20世紀50年代中期,美國海軍武器實驗室(NOL)和尤拉卡-威廉斯(Eurelca-Williams)公司首先研究成功Mg/V2O5片型熱電池,從而使熱電池的制造工藝從陳舊的杯型工藝向新穎的片型工藝過渡,使熱電池的性能上了一個新臺階,這是熱電池發展史上一個重要里程碑。
1961年SAND實驗室利用上述成果開始研制片型的Ca/CaCrO4體系的熱電池。1966年第一個完整的片型熱電池投產,從而片型Ca/CaCrO4熱電池成為美國使用在核武器上的主要能源,使它的比能量、比功率得到很大提高,特別是大大延長了電池的使用壽命(從5min延長到60min),總之,20世紀60年代和70年代初期是熱電池,特別是Ca/CaCrO4熱電池大發展的時期。
鈣系熱電池具有放電時間長、工作電壓高、激活可靠、使用安全、能耐苛刻環境條件的特點,片型工藝的出現及一些高效絕熱材料的應用,使熱電池的比能量、比功率得到很大提高,特別是大大延長了熱電池的工作壽命,使其工作壽命達到1h左右。但Ca/CaCrO4體系熱電池還存在一些致命缺點。
首先該電池易形成Li-Ca合金。該合金在電池工作溫度下是可流動的液體,因而容易引起電池短路和產生電噪聲;其次鈣陽極與CaCrO4往往發生難以預測的放熱反應,從而引起電池熱失控導致電池壽命提前結束;再次是電池在放電過程中,鈣陽極表面產生一層惰性復鹽膜(KCa-Cl3),引起電極嚴重極化。
為了克服這些缺點,1970年英國海軍部海上技術研究中心研究鋰作陽極,硫作陰極的熱電池,但由于硫在高溫時易揮發,后來改用FeS2和熔點高的鋰合金作為陰陽極材料。
20世紀70年代中期SAND實驗室利用美國海軍材料實驗對鋰合金陽極的研究成果和阿貢實驗室對二次LiMx/FeS2蓄電池研究成果,研制成片型化的小型長壽命LiMx/FeS2熱電池,各項技術指標大大超過過去任何一個電化學體系的熱電池,這是熱電池發展史上又一重大技術突破
由于熱電池具有突出的優良性能,在現代武器上得到廣泛的應用,從而促進了現代武器性能的提高。現代武器的快速發展又對熱電池提出了更新、更高的要求。快激活、長壽命、大功率熱電池必將成為下一步熱電池研究的熱點。
熱電池的研究方向
快激活熱電池
熱電池的激活時間是指從熱電池激活信號到熱電池達到所規定的工作電壓下限所需時間。激活過程是當電點火頭或火帽接到激活信號后燃燒點燃引燃條,引燃條再引燃加熱片,加熱片加熱使電池堆處于工作溫度范圍之內,使電解質熔融后,熱電池開始工作。激活時間一般為0.5~2S。為縮短熱電池的激活時間,一方面必須提高引燃條和加熱片的燃燒速度,另一方面則需提高熱電池的電解質的熱傳導速率,電解質熔融的速度對縮短熱電池的激活時間也有相當重要的影響。通過以上改進措施,熱電池的激活時間可達到0.2S,甚至可達到0.1S內。
長壽命熱電池
熱電池中,工作壽命為60rrdn左右的電池稱之為長壽命熱電池。隨著武器系統發展的需要,長壽命熱電池的研究也日益重要。要使熱電池達到長壽命技術要求,必須解決以下幾個問題:
(1) 陰極材料的熱分解。目前大多數熱電池均采用FcS:作為陰極材料,二硫化鐵作為短壽命熱電池的陰極材料比較理想,但作為長壽命熱電池的陰極材料,二硫化鐵在熱電池的工作溫度450~550℃范圍內存在比較嚴重的熱分解,影響熱電池放電容量和放電時間。具有放電電壓平臺多、成型好、化學性能穩定等優良的電化學性能特點的復合陰極材料,是今后作為長壽命熱電池陰極理想的材料。CoS:也是長壽命熱電池陰極材料的不錯的選擇。
(2) 熱電池電解質在放電過程中熔點升高。LiC1.KC1電解質在放電過程中Lr離子通過電解質從陽極向陰極遷移,在電解質中形成濃度,同時陰極從電解質中吸取離子形成復鹽。當Li+/K+的比例發生變化時導致電解質熔點升高,提早凝固,電池壽命終止。可采用Li+/K+的比例發生對最低共熔點變化不敏感的電解質如:KC1.LiBr—KBr三元電解質來作為長壽命熱電池的電解質。
(3) 延長熱電池的熱壽命。熱電池的內部溫度必須維持在一定范圍內才能使熱電池正常工作,這種維持在一定溫度范圍內的時間稱之為熱壽命。采用輕質、多孔、高效的Min.K型保溫材料可提高熱電池的熱壽命。
大功率熱電池
要實現高比功率特性,除要求材料本身電化學極化要小外,還要求材料本身的電導率較高,以降低歐姆極化。CoS的電阻率為0.002Q·cm,遠低于FeS2的17.71-/·cm,更有利于降低電極的歐姆極化;通過掃描電鏡(SEM)分析表明人工合成CoS:為近球形多孔網絡狀結構,增加了CoS的比表面積,有利于降低電化學極化。CoS:大電流負載下陰極極化小,高溫放電活性物質利用率高,CoS:實際高低溫的平均容量比FeS高44%,這些特點很適合于高比功率、長壽命熱電池設計,是進一步提高熱電池性能的首選材料。
鋰系熱電池主要技術方向
目前,鋰系熱電池是熱電池的主導產品并將逐步替代老式熱電池。研究者們對鋰系熱電池的研究主要集中在電極材料和電解質上。
熱電池陽極電極材料
在熱電池中,陽極不僅參加電化學反應,而且還起到導電作用。熱電池的陽極材料一般采用電極電位較負的金屬材料,如鈣箔、鎂粉、鋰合金等。從Et前熱電池的發展來看,采用鋰陽極日益增多,鋰陽極可以避免鈣陽極的一些缺點。但鋰直接作為熱電池的陽極,其熔點較低,在熱電池的工作溫度下呈液態,易從多孔集流器中溢出。為使鋰陽極不為液態,一般采用鋰合金作為陽極,其熔點高又基本保持了鋰的電化學特性。在鋰系熱電池發展初期,Li—A1代替鋰電極作為熱電池陽極材料。相對于Li—Al陽極而言,Li.si陽極具有更好的性能,因而在熱電池發展中,Li.A1在應用一段時間后,就很快被Li—Si所取代。目前在軍事科學領域應用中,熱電池主導產品為Li—Si/FeS電池。Li.si合金電極材料的制備工藝比較簡單,主結構為LiI,si4(化學計量成分)。Li.si合金電極在放電過程中,隨鋰含量的降低,電極電壓出現5個平臺,各平臺間有一個平滑過渡區,通常只利用第一個平臺。Li—B合金是繼金屬鋰、Li.A1、Li—si合金之后又一重要的新型熱電池陽極材料。Li.B合金的性能較Li—si合金又有很大提高,其電化學性能與純鋰十分接近。鋰硼合金中活性鋰利用率達70%時,電位仍然很穩定,而鋰硅合金不僅活性鋰含量低,利用率只有20%。Li—B合金是現今比功率、比容量最大的熱電池陽極材料。
熱電池陰極電極材料
在鋰系熱電池中,優良的陰極活性物質一般需要具有以下特點:電極電位高,相對于鋰電位最好大于3V;具有高的熱穩定性;與電解質不發生反應;具有電子導電性,能夠大電流放電;生成的反應產物能夠導電或能溶人電解質,減小內阻。鋰系熱電池的陰極材料通常采用電位較正的金屬硫化物、氧化物以及氯化物。
(1) 硫化物陰極材料
過渡族金屬硫化物是一類很好的熱電池陰極材料,通常采用電位較正的金屬硫化物或鹽類。用它取代硫做陰極材料,可解決高溫下硫蒸汽的逸散問題,大大降低可溶于電解質的多硫化物的形成。FeS是目前應用最廣泛的與鋰合金陽極匹配的熱電池陰極材料。二硫化鐵有人工合成的,也有從天然礦石中提取的,鋰系熱電池使用的二硫化鐵主要來源于天然產出的二硫化鐵。研究表明,FeS陰極材料可直接從黃鐵礦中加工得到,價格便宜,電性能穩定。但是FeS,在高于550℃時發生熱分解,生成硫蒸汽與陽極鋰合金直接化學反應產生大量的熱量,使熱電池熱失控直至完全失效。另外,在電池激活瞬間,單體電池會產生0.2V或更高的電壓脈沖即瞬間電壓尖峰,使電壓平穩性下降,縮短電池的工作壽命。為消除電壓尖峰,解決FeS:的熱穩定性問題,廣大學者做了很多方面的工作。目前最有效的常規方法是采用Li:O等鋰化劑對FeS:進行鋰化處理,從而大大消除電池的初始電壓尖峰并提高電池壽命終結時的脈沖性能。此外,采用合成納米結構的FeS:作為陰極也為FeS,的應用指出了新的發展方向。相較于資源豐富的FeS,CoS粉末只能采用人工合成的方法。人工合成CoS粉末的方法有:晶種誘導水熱合成CoS粉體、溶劑熱法合成CoS納米粉體、水熱法制備CoS:空心微球以及高溫硫化法。人工合成CoS,粉末大部分的顆粒都成近球形,顆粒表面比較疏松成發達的多孔狀結構。與表面光滑平坦的FeS晶體相比,CoS的結構大大提高了正極材料的比表面積,從而可提高正極工作電流密度、正極材料的利用率。因此多孔網狀的CoS正極材料更適合于發展高比功率和比能量的熱電池,是能代替二硫化鐵的理想陰極材料。
(2) 氧化物陰極材料
由于存在嚴重的熱分解,二硫化鐵是比較理想的短壽命陰極材料。Clark用溴化鋰對VO、VO進行鋰化處理制得鋰化的氧化釩(LVO),作為熱電池的陰極材料,與二硫化鐵相比具有較高的電壓和更好的熱穩定性。LVO優點如下:混合物的熱穩定性較好;電極電位很正,相對鋰為2.8V;化學穩定性好,若把它與一定比例的FeS混合作為陰極,則除保持原有的優點外,還可顯著提高熱電池的后期放電效果。
(3) 氯化物陰極材料
金屬氯化物(特別是氯化鎳)是可替代二硫化鐵的較為理想的陰極材料之一,具有理論容量高、放電電流密度大、電極電位正等特點。以高溫處理氯化鎳為正極材料的熱電池,氯化鎳熱電池在放電后期,由于氯化鎳與全鋰電解質在高溫時發生相互熔浸,電池的電解質材料流溢出電堆現象嚴重。研究表明,在氯化鎳熱電池中,電解質不宜選用二元電解質,鋰硅合金不適合做負極。以氯化鎳為正極,Li.B合金為負極,電解質選用全鋰j元電解質制備電池進行放電試驗,研究表明樣品電池放電電壓曲線平滑、無極化現象、無微短路現象;電池激活時間1.6S,樣品電池的比能量達到84Wh/kg(這是熱電池中較高的水平)。電池正、負極利用率都達到較高的水平,在進一步改進電池粉量配比后,電池的比能量仍有提高的可能,而且激活時間也有望縮短。
熔融硝酸鹽電解質
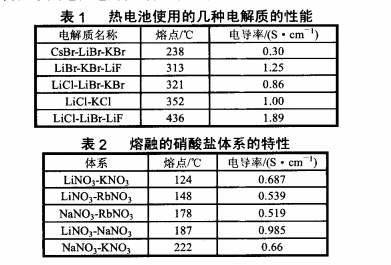
近年來,國外的一些熱電池實驗室(SNL、SAFTAmerica公司)采用熔融的硝酸鹽應用于鋰體系熱電池電解質。由于該體系的低溫工作區間、單體電壓高、比能量高等優點,作為熱電池電解質其應用備受關注。熱電池的熔融鹽電解質具有水溶液電解質所無法比擬的優越性:非流動性;高電導率及離子遷移速度大,允許大功率大電流放電;分解電壓高,可以使用與水反應的超低電位金屬及其合金作陽極,從而使電池電壓高,比能量大;活性物質利用率高,電化學極化和濃差極化都很小。傳統熱電池電解質可選用堿金屬和堿土金屬的氟化物、氯化物、溴化物以及它們的低共熔點混合物。但這些電解質的熔點相對較高,電池的工作溫度基本都在300~500℃。據國外的文獻報道,國外的一些熱電池實驗室采用熔融的硝酸鹽作為鋰體系熱電池電解質,電池工作溫度范圍低(150~300℃ );鋰體系陽極能夠與之兼容;組合電池采用高電壓陰極與鋰合金配對,電池的單體電壓和比能量較傳統熱電池明顯提高。表1是傳統鋰系熱電池電解質體系特性,表2是常用的熔融硝酸鹽體系一些特性。可見硝酸鹽體系的熔點均小于300℃,且有較好的電導率,因此該體系應用于熱電池中,體系溫度較傳統鋰系熱電池降低至少100℃,該體系與傳統鋰系熱電池電解質都具有良好的導電性。
保溫材料
要使熱電池正常工作,必須維持在一定的溫度范圍內。通常在電池堆體的周圍使用一定的保溫材料來達到在較長時間內維持一定的溫度的目的。保溫材料性能好壞對熱電池的性能(特別是工作時間)會產生很大的影響。
Min-k保溫材料主要以氣相SiO或SiO氣凝膠粉末為主體,添加TiO2等作為遮光劑,加入一定量的纖維作為增強劑,經過混合后壓制而成。氣凝膠是一種新型的輕質納米多孔性非晶固態材料,其比表面高達1000m2/g、孔率達80%~99.8%,孔洞的典型尺寸為1~100hi/1。它被認為是固體中熱導率很低的材料。這是因為:氣凝膠的纖細納米多孔性結構能有效地限制局域激發的傳播,其固態熱導率比相應的玻璃材料低2~3數量級;氣凝膠的典型孔洞尺寸在幾納米到幾十納米之間,小于常壓下空氣分子的平均自由程,因此氣體熱導率很低;摻雜遮光劑的氣凝膠能使輻射熱傳導在一定厚度內被有效地吸收,即輻射熱導率也很低。在常溫常壓下,氣凝膠的導熱系數可達O.015W/(m·K)。即使在527℃的溫度下,其導熱系數也只有0.038W/(m-K)。氣凝膠雖然有較好的保溫性能,但機械強度較差。為了提高強度,可以在制備的過程中加入纖維進行增強。真空絕熱體采用不銹鋼制成的雙層夾套殼體,夾套內抽真空,其保溫原理和熱水瓶相同。若在真空室放人填充材料,如鋁箔、玻璃纖維等,保溫性能將大大提高。
熱電池發展展望
自20世紀70年代鋰合金/二硫化鐵電池問世以來,世界上幾個主要軍事強國對該種熱電池的興趣倍增,80年代得到非常迅速的發展。可以預見,
鋰合金/二硫化鐵熱電池將全面替代目前還在使用的幾個比較落后的熱電池體系。21世紀是鋰合金/二硫化鐵電池的全盛時期,隨著材料特別是新型保溫材料的發展,到那時長壽命熱電池組的壽命將超過2h,功率為幾千瓦級熱電池組可能問世。穩態放電電流密度可能達到8~10A/cm2,脈沖放電電流密度可能超過50A/cm2,電池組的性能得到進一步提高,比功率大大超過目前水平。
隨著熱電池研究的不斷深化,熱電池必將在武器應用方面不斷發展,在軍事上占有越來越重要的地位
